FACTORES QUE AFECTAN LA VELOCIDAD DE REACCIÓN.
Como ya sabemos, la velocidad de reacción es determinada al medir la cantidad de un reactivo o la cantidad de un producto formado en un determinado tiempo, sin embargo, existen ciertos factores que pueden modificar la velocidad de la reacción, los cuales son:
- NATURALEZA QUÍMICA
- CONCENTRACIÓN
- TEMPERATURA
- PRESIÓN
- TAMAÑO DE PARTÍCULA
- CATALIZADORES
NATURALEZA QUÍMICA
Las reacciones químicas se ven favorecidas cuando "Todos los reactivos se encuentran en la misma fase":- todos son líquidos
- todos son gases
Si se cumplen estas condiciones el contacto entre reactivos es mas estrecho, pues se difunden unos de otros y la reacción se lleva acabo sin problemas.
Los procesos químicos que se llevan a cabo entre reactivos en diferente fase (gas con solido), en estos casos la reacción se lleva a cabo en interfase, esto quiere decir que se lleva a cabo en la superficie de contacto entre ambos reactivos. En estos casos, si la superficie de contacto es pequeña, la velocidad de reacción es pequeña y si la superficie de contacto es grande, favorece la reacción y por consecuencia se incrementa la velocidad.
CONCENTRACIÓN
Dentro de una reacción química, sucede que al aumentar la concentración de uno de los reactivos, se multiplica la velocidad de reacción
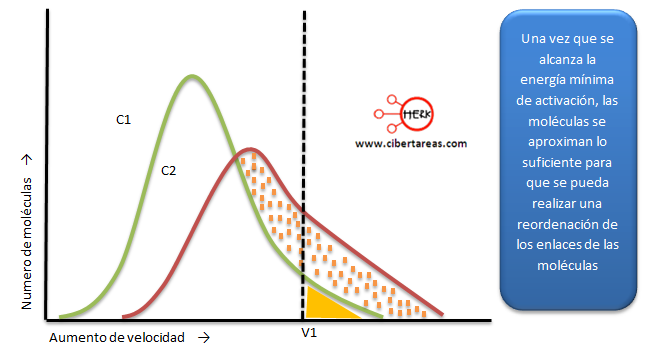
imagen tomada de:http://cibertareas.info/wp-content/uploads/2013/10/factores-que-modifican-la-velocidad-reaccion-concentracion-quimica-1.png

De acuerdo con la teoría de las colisiones, para que se produzca una reacción química tienen que chocar entre sí las moléculas reaccionantes. Ahora bien, según la teoría cinética, el número de choques es proporcional a la concentración de cada uno de los reactivos. Por tanto, la velocidad de reacción será proporcional a la concentración de cada uno de los reactivos.
En las reacciones elementales, la velocidad de reacción es proporcional al producto de las concentraciones de los reactivos, elevadas a sus respectivos coeficientes estequiométricos. Esta es la llamada ley de acción de masas.
TEMPERATURA
En casi todos los casos, elevar la temperatura de los productos químicos aumenta la velocidad de su reacción. Esta reacción se debe a un factor conocido como "energía de activación." La energía de activación para una reacción es la energía mínima que dos moléculas necesitan con el fin de chocar junto con la fuerza suficiente para reaccionar.
Una regla muy básica es que la velocidad de reacción se duplica por cada 10 grados Celsius de aumento de la temperatura.
 |
| imagen tomada de : http://www.monografias.com/trabajos37/velocidad-de-reaccion/Image8612.gif |
A medida que aumenta la temperatura, las moléculas se mueven con más fuerza, y más de ellas tienen la energía de activación requerida, aumentando la velocidad de la reacción.
PRESIÓN
La velocidad de las reacciones gaseosas se incrementa muy significativamente con la presión, que es en efecto, equivalente a incrementar la concentración del gas. para las reacciones en fase condensada, la dependencia en la presión es débil y solo se hace importante cuando la presión es muy alta |
| imagen tomada de: http://montenegroripoll.com/Quimica2/Tema5/Factores_archivos/image002.gif |
Nota: A MAYOR PRESIÓN LA VELOCIDAD AUMENTA
TAMAÑO DE PARTÍCULA
Cuando los reactivos se encuentran en diferente fase, existe un forma de incrementar su velocidad de reacción esta consiste en:
Entonces podemos decir, que entre mas pequeña es la partícula, es mas rápida en la velocidad de reacción y entre mayor sea la cantidad la reacción actuara mas rápido.
 |
| imagen tomada de: http://cibertareas.info/wp-content/uploads/2013/10/tama%C3%B1o-de-la-particula-quimica-1.png |
CATALIZADORES
 |
| imagen tomada de: http://cibertareas.info/wp-content/uploads/2013/10/factores-que-modifican-la-velocidad-reaccion-catalizadores-quimica-1.png |
características de los catalizadores:
- habitualmente se recogen al final de la reacción
- solo se necesitan en cantidades muy pequeñas para producir una reacción considerable
- con el tiempo experimentan un proceso de desgaste
- no puede provocar una reacción que no se pueda realizar por si misma
- hay un catalizador para cada reacción: haciendo que la energía de activación sea menor
- forman compuestos intermedios
- cambia el MECANISMO de la reacción
- aparecen químicamente inalterados al final de la reacción
- los catalizadores no inician la reacción
los catalizadores que ralentizan las reacciones, aumentando la altura de la barrera de energía, se llaman inhibidores.
FUENTES CONSULTADAS:
todas las fuentes e imagenes fueron tomada el dia 16 de sep tiembre de 2015


El diseño es muy bueno, la información también
ResponderBorrarMuy buen trabajo muchachos!!! Me encanto!!, manejaron en general muy bien sus recursos, información, diseño, etc!Les felicito!!
ResponderBorrarGracias
ResponderBorrar