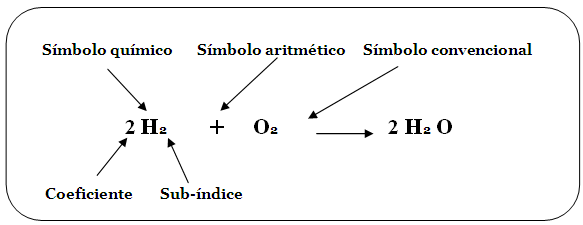
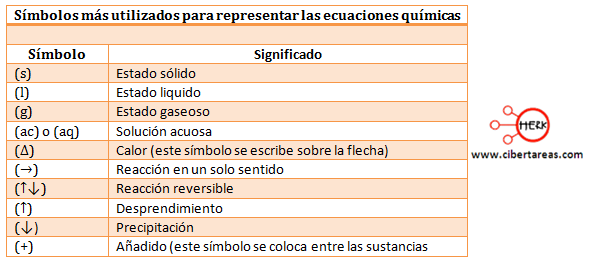
BALANCEO DE ECUACIONES QUÍMICAS POR MÉTODO REDOX
Redox es un tipo de reacción donde una sustancia transfiere
electrones a otra sustancia. Por ejemplo, el funcionamiento de una batería de automóvil
se debe a una reacción Redox.
Aunque se crea lo contrario, la sustancia que se oxida se le
conoce como agente reductor (puesto que reduce a otra sustancia), mientras que
la sustancia que se reduce se le llama agente oxidante. Estas dos reacciones
siempre van de la mano, no puede existir una sin la otra.
Puntos clave:
ü
Los elementos libres ( que no están combinados)
tienen por predilección un numero de oxidación de 0
ü
Ion monoatómico su número de oxidación debe ser
igual a la carga iónica.
ü
Los metales combinados con no metales deben
tener un numero de oxidación positiva.
ü
No metales combinados con metales deben dar un número
de oxidación negativo.
ü
Dos no metales combinados dan 1+ excepto los
hidruros (1-)
ü
Oxigeno generalmente posee 2- excepto en los peróxidos
(1-)
ü
Un compuesto neutro, la suma de sus números de oxidación
debe dar 0
BALANCEO
El primer paso es asignar el número
de oxidación de cada elemento de la reacción. De modo que si un elemento empezó
con un número de oxidación pero termino con otro, demuestra que ha sido
afectado y por lo tanto se debe escribir como una semirreacción, como se demuestra:
HNO3
+ S → NO2 + H2SO4 + H2O
H1+N5+O2-3
+ S0 → N4+O2-2
+ H1+2S6+O2-4 + H1+2O2-
Como se puede apreciar, el Nitrógeno
(N) ha cambiado de numero de oxidación, paso de 5+ a 4+, de acuerdo a la tabla
de arriba, se puede decir que se ha reducido, por lo que es el agente oxidante,
mientras que el Azufre (S) ha pasado de tener 0 a 6+ por lo que se oxido (esto
quiere decir que es el agente reductor)
El siguiente paso implica las semirreacciones,
una vez definidas, se debe de igualar el número de electrones que se han ganado
o perdido, en este caso el nitrógeno gano un electrón, mientras el azufre perdió
6 electrones. (Revise tabla OPERGE)
Para igualarlas debe multiplicar
alguna (o ambas) semirreacciones para que los electrones sean los mismos, en
este caso, multiplicaremos al nitrógeno por 6.
6(N5+ → N4+)
1(S0 → S6+)
*NOTA: Si multiplicas (en este caso
el nitrógeno) debes multiplicarlo todo (N5+ Y N4+) = 6N5+
y 6N4+
Lo que sigue en este método es
sustituir las semirreacciones que ahora tenemos, de forma que donde iba N5+
ahora debe ir 6N5+
6HNO3
+ S → 6NO2 + H2SO4 +H2O
Para concluir, cabe decir que si
existe agua (H2O) en la reacción, este estará desbalanceado, y para
concluir nuestro balanceo, este se debe hacer por el método de tanteo, de forma
que esta reacción concluye así:
6HNO3
+ S → 6NO2 + H2SO4 +2H2O
16/09/15
Química- T. Flores de L. / C. García
de D. I. / M. García G. / A. Ramírez de D.
Química – Daub Seese / Carrillo
Gonzales / Montagut Nieto Sansón. (Octava edición)
Química – William S. Seese / G.
William Daub (quinta edición)
http://study.com/cimages/multimages/16/oxidation-reduction-ion-image.jpg
Otras imagenes por Fabiola Amador