REACCIONES DE DESPLAZAMIENTO SIMPLE
Estas reacciones son conocidas como reacciones de
sustitución simple o de desplazamiento. En este tipo de reacciones, un elemento
reacciona sustituyendo o reemplazando a otro dentro de un compuesto de la
siguiente manera:
Metales nobles
<Hidrógeno <metales
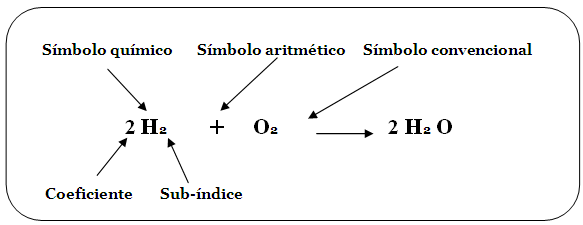
Se representan con dos fórmulas generales:
Ø
Un metal desplaza a un ion metálico en su sal o
a un ion hidrógeno en un ácido:
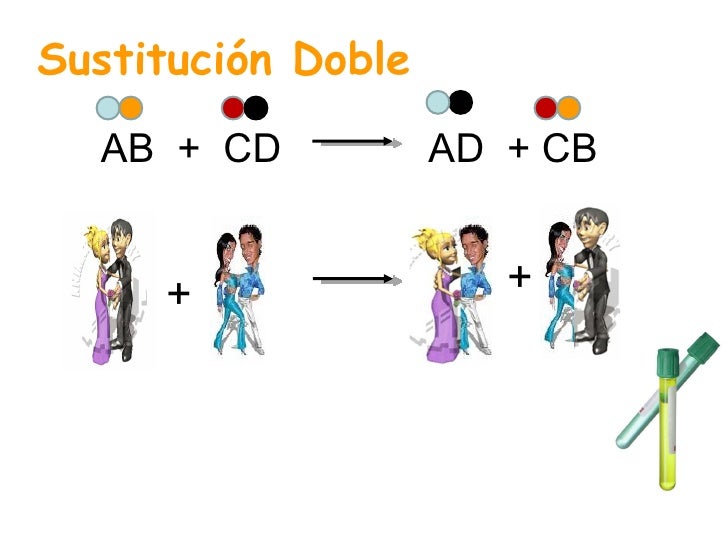
Ø Un
metal substituye a un ion no metálico en su sal:
En la primera reacción se depende
de los metales (A y B), estos se acomodan de acuerdo a una serie llamada electromotriz
(1), de tal modo que cada elemento de la misma desplazara de una solución
acuosa de su sal, a cualquiera de los que le siguen.
*Nota: aunque el hidrógeno no es
un metal, se le incluye en esta serie.
Para los metales que tienen varios
números de oxidación, se forma la sal con el ion que posee el número más bajo.
El ion hidrógeno también puede ser desplazado del agua.
2K + H2O(l) → 2KOH(AC)
+ H2(G)
En el segundo caso la sustitución
depende de los no metales participantes (X y Z). Existe una serie parecida a la
electromotriz (1) para los halógenos, donde el halógeno de la
izquierda sustituye a los de la derecha.
(1)
16/09/15
Química- T. Flores de L. / C. García
de D. I. / M. García G. / A. Ramírez de D.
Química – Daub Seese / Carrillo
Gonzales / Montagut Nieto Sansón. (Octava edición)
Química – William S. Seese / G.
William Daub (quinta edición)
*Imagenes realizadas por Fabiola Amador.